3月26日,中國農業科學院哈爾濱獸醫研究所基礎免疫創新團隊賈洪林課題組同日本東京大學水島升(Noboru Mizushima)教授以及京都大學、長崎大學等的研究者合作,在原蟲中發現了一種類泛素化系統的進化現象。該研究進一步加深了對泛素和類泛素蛋白與底物共價結合的生物學意義的理解。相關研究成果在線發表在《自然結構與分子生物學(Nature Structural & Molecular Biology)》上。
泛素和類泛素蛋白是一種小分子蛋白,參與多種多樣的細胞生物學過程,包括蛋白酶體途徑和自噬途徑的蛋白降解,動植物機體的免疫應答,動植物細胞內的DNA修復以及信號傳導等。這些小分子蛋白通過異肽鍵共價結合到底物分子上,從而對底物分子進行修飾。
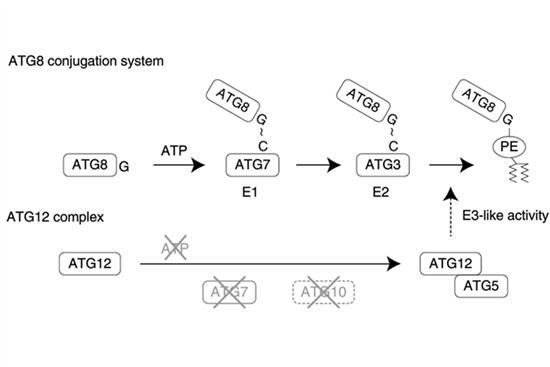
類泛素蛋白和底物共價偶聯過程中都需要消耗三磷酸腺苷(ATP)并且依賴于泛素激活酶、泛素偶聯酶以及泛素連接酶的作用。目前普遍認為,這樣的共價結合機制使得類泛素蛋白不需要和各種不同底物間形成相互作用面,從而有利于類泛素蛋白和多種底物牢固的結合。但是,如果類泛素蛋白只有一種底物的時候,就沒有必要利用這種消耗能量的共價結合機制進行結合。
科研人員在原蟲和酵母中發現了這一理論的直接證據。在弓形蟲和瘧原蟲中,類泛素蛋白ATG12和ATG5以非共價鍵的形式結合,但是仍然具有促進自噬相關蛋白ATG8酯化的活性。一些酵母(例如Komagataella phaffii)的ATG12和ATG5也存在類似的非共價結合。該研究發現了類泛素蛋白共價結合向非共價結合作用的進化方式的直接證據,為理解類泛素蛋白分子作用機制提供了新的依據。
原文鏈接:https://rdcu.be/bsQRF