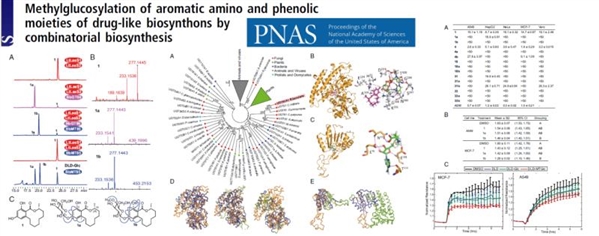
5月14日,中國農業科學院生物技術研究所微生物功能基因組創新團隊最新成果發表在《美國國家科學院院刊》(PNAS)上。該研究創新性地將兩種從真菌中發現的可對多種藥物先導化合物進行修飾的關鍵酶集成起來,構建合成生物學功能模塊。這種模塊修飾的多種化合物在實驗中表現出顯著提升的水溶性和代謝穩定性,在制藥領域有重要的應用價值和廣泛的應用前景。
水溶性和代謝穩定性是確保藥效(包括臨床藥物、農藥和獸藥)的關鍵因素。糖基化修飾能改善藥物分子的水溶性,從而提高有效性,如大環內酯類的紅霉素(醫用)和泰樂菌素(農用)只有經糖基化修飾后才具有抗生素活性。然而糖基化修飾的化合物在生物體內容易被水解,代謝穩定性較差;將糖基進一步修飾為糖甲基,則可在保持水溶性的同時,增加代謝穩定性,更好地發揮藥效。與化學方法相比,利用生物方法將具有重要應用潛力的藥物先導化合物進行甲基糖基化修飾,具有修飾精準、環境友好等優勢。
生物所徐玉泉課題組、林敏課題組與美國亞利桑那大學教授伊思萬·莫納研究團隊及多家單位合作,利用多組學、生物合成途徑以及化學生物學分析,首次在真菌中發現了含有新型糖基轉移酶家族的糖基轉移酶-甲基轉移酶模塊(BbGT-BbMT)。通過系統發育和結構分析,深入解析了糖基轉移酶的進化關系,以及糖基轉移酶-甲基轉移酶模塊生物催化的分子機制。使用合成生物學平臺,成功地實現了對黃酮、蒽醌和萘酚等45種藥物先導化合物的結構修飾,顯著提升了這些化合物的水溶性。在大腸桿菌、酵母、哺乳動物細胞模型中表現的化合物代謝穩定性從平均50%左右提高至95%以上。值得一提的是,該修飾顯著提高了去甲基毛色二孢霉素(ldesmethyl-lasiodiplodin)和monocillin Ⅱ兩種化合物抑制癌細胞擴散的能力,同時降低了對正常細胞的毒性,極大地增加了該化合物在抗癌藥物研發中的潛力。
本工作由國家重點基礎研究發展計劃、國家自然科學基金和中國農科院青年英才計劃資助。